Was bestimmt die Spezifität einer Tyrosinkinase?

Der Insulinrezeptor (IR) und der nah verwandte insulin-like growth factor-1 receptor (IGF1R) sind Mitglieder der Familie der transmembranständigen Rezeptortyrosinkinasen. Nach Stimulation durch Insulin zeigt der IR in der Autophosphorylierung eine duale Aktivität, .h. Phosphorylierung von Tyrosin- und Serinresten. Wird die lösliche Insulinrezeptorkinase als dimeres GST-Fusionsprotein expremiert, so zeigt diese Kinase auch in der Autophosphorylierung duale Aktivität. Duale Substratphosphorylierung durch IR bzw. IGF-1R konnte nur beobachtet werden, wenn im Phosphorylierungsansatz PolyLysin als „Vernetzer“ in äquimolaren Konzentrationen vorlag.
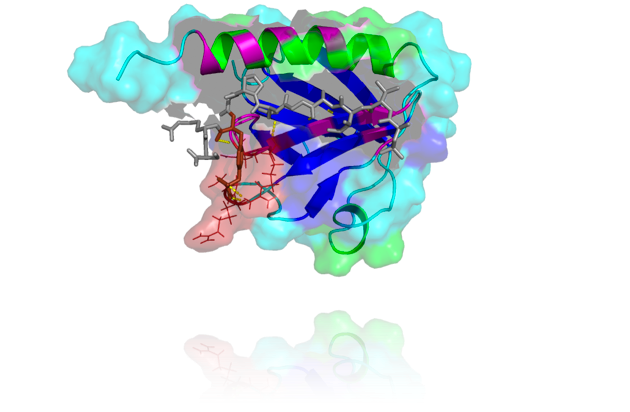
In der vorliegenden Arbeit wurden die Auswirkungen von Kinase-Substratkomplexen auf die Spezifität von Kinasen und auf nachgeschaltete Effektoren untersucht. Als Modellsubstrat wurde die Phosphotyrosin-bindende Domäne (PTB) des humanen Insulinrezeptorsubstrat (IRS-1) verwendet. Die PTB-Domäne weist sowohl die Eigenschaften eines „Vernetzers“ auf, ist jedoch gleichzeitig ein geeignetes Substrat für die Kinasen des IR und IGF-1R. Dazu wurden verschiedene Varianten der PTB-Domäne kloniert, gereinigt und in Kinase-Assays eingesetzt. Als Modellenzyme wurden die lösliche, dimere GST getagte Kinasedomäne des IGF-1R verwendet, sowie eine Mutante dieser Kinase, in der die PTB-Bindung durch Substitution des essenziellen Tyrosin950 stark abgeschwächt ist.
Es konnte gezeigt werden, dass Kinase und Substrat einen stabilen Komplex eingehen. Auf nachgeschaltete Effektorkinasen hat dieser Proteinkomplex weitreichende Auswirkungen. Eine Effektorkinase außerhalb des Signalosoms zeigte nur geringe katalytische Effizienz für das Substrat im Signalosom.
Kinase und Substrat bilden 1:1-Komplexe, sodass eine „quasi“-intramolekulare Reaktion stattfindet. Somit unterliegt der Mechanismus der Substratphosphorylierung im Komplex keiner Michaelis-Menten-Kinetik.
Durch den Kinase-Substrat-Komplex wird nicht nur die Aktivität der komplexierten Tyrosinkinase gesteigert, sondern darüber hinaus ihre Spezifität von Tyrosinphosphorylierung auf Serin- und Threoninphosphorylierung erweitert. Wird die Komplexbildung auf Seite der Kinase oder des Substrats pertubiert, so konnte keine Phosphorylierung des Substrats mehr beobachtet werden.
Aufgrund dieser Ergebnisse wird ein Modell der Kinasespezifität postuliert, das zwischen der Proteinbindung über „Docking“-Domänen und der Bindung von Substraten im katalytischen Zentrum unterscheidet. Dieses Modell erklärt die Spezifität von Tyrosinkinasen: Einer Kinase wird für jeden Phosphorylakzeptor im Substratprotein eine Präferenz zugeordnet, unabhängig davon, ob es sich um ein Tyrosin, Threonin oder Serin handelt. Diese Präferenz wird durch die Eigenschaften des Kinase-Substrat-Komplexes bestimmt. Hier ist die Aufenthaltsdauer des „Docking“-Proteins im Komplex mit der Kinase, sowie die Flexibilität der zu phosphorylierenden Aminosäurereste, entscheidend.