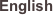

Dimerisierung führt bei Rezeptortyrosinkinasen (RTK) zur Aktivierung der Kinaseaktivität, die sich in der Autophosphorylierung der Dimere niederschlägt. Nach gängiger Meinung (Schlessinger et al. 1988/1989; Lammers et al. 1990; Ullrich et al. 1990) erfolgt die Phosphorylierung der Dimere in trans, d.h. die Untereinheiten phosphorylieren sich gegenseitig. Demnach sind Dimerisierung und trans-Autophosphorylierung unentbehrlich für den Aktivierungsprozess. Eine entscheidende Rolle bei der Aktivierung des Insulinrezeptors (IR) wird den Tyrosinpositionen der Aktivierungsschleife (Y1146, Y1150 und Y1151) zugesprochen (White et al.,. 1988). Des weiteren phosphoryliert die Insulinrezeptorkinase rezeptoreigene und im Substrat befindliche Serinreste und ist somit eine Kinase mit dualer Spezifität.
In zahlreichen Mutationsanalysen wurde die Rolle der einzelnen Tyrosine für den Aktivierungsprozess des IRs und für die Signaltransduktion kontrovers diskutiert ( Tavare et al. 1991; Wilden et al. 1992; Zhang et al. 1991; Dickens und Tavare 1992). Jedoch ergab sich in in vivo- und in vitro- Untersuchungen kein eindeutiges Bild über die Bedeutung der einzelnen Tyrosinphosphorylierungsstellen. Dies kann an den unterschiedlichen Methoden liegen, die einen Vergleich der verschiedenen Ergebnisse erschweren. Allen Arbeiten ist gemeinsam, dass sich die Substitution aller drei Phosphorylierungsstellen in einer deutlichen Reduktion der Kinaseaktivität äußert (Wilden et al. 1992).
Nicht nur die Bedeutung der Phosphorylierungsstellen, sondern auch die Reihenfolge ihrer Besetzung ist umstritten. Die Meinungen reichen von einer zufälligen Besetzung (Tavare und Dickens 1991) bis hin zu einem geordneten Besetzungsmuster (Dickens und Tavare 1992; Wei et al. 1995), wobei zwischen zwei möglichen Reihenfolgen unterschieden wird.
Um ein homogenes Reaktionsfeld zur Analyse der zugrunde liegenden Mechanismen zu schaffen, wurden in dieser Arbeit unterschiedliche mutierte Homo-und Heterodimere Kinasekonstrukte des Insulinrezeptors generiert. Alle hergestellten Konstrukte wurden als GST-Fusionsproteine in den Sf9-Zellen exprimiert und affinitätschromotographisch gereinigt und in ihrer Aktivität in Auto- und Substratphosphorylierung charakterisiert. Die Untersuchung der verwendeten Kinase-Mutanten führte zu folgenden Ergebnissen:
-
✴In Autophosphorylierungsreaktionen wiesen alle mononemeren, homo- und heterodimeren Kinasekonstrukte katalytische Aktivität auf. Folgende Tendenz konnte verzeichnet werden: WT=Y1151F=Y1146F>Y1150F. Keine der Mutationen in den potentiellen Phosphorylierungsstellen führte demnach zu einer Knockout-Mutante.
-
✴Ein Vergleich der Hybride mit den zugehörigen homodimeren Referenzkinasen zeigte eine vergleichbare Aktivität der aktiven Untereinheiten im Hybrid und im Homodimer.
-
✴Die Phosphopeptidkartierung der C-terminal verkürzten Kinasemutanten zeigt die Besetzung aller Tyrosine der Aktivierungsschleife, vergleichbar mit den Hybriden.
-
✴Es wurden deutliche Unterschiede im Verhalten der einzelnen Mutanten in der Auto- und Substratphosphorylierung verzeichnet. Die Aktivität in der Substratphosphorylierung nahm in der Reihenfolge WT≥Y1146F>Y1150F>Y1151F ab. Die Besetzung der Position Y1151 spielt offenbar eine untergeordnete Rolle für die Autophosphorylierung, scheint jedoch für die Substratphosphorylierung bedeutend zu sein.
-
✴Alle Kinasekonstrukte mit den Mutationen Y1150F und Y1151F haben die Fähigkeit zur dualen Phosphorylierung weitgehend verloren.
Hybrid Kinasen