| CI: Chemische Ionisation | |||||||||||||||||||||||||||
|
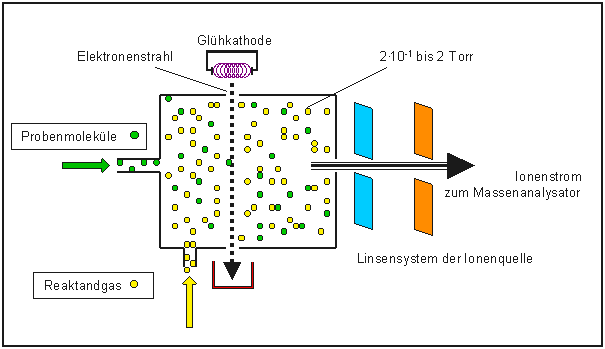
Bei der Chemischen Ionisation wird in die Ionenquelle zu den thermisch verdampften Probenmolekülen ein
Überschuß an Reaktantgas eingelassen, das durch Elektronenbeschuß (150 eV) ionisiert wird.
Es resultiert ein Druck in der Ionenquelle von etwa 2•10-1 bis 2 Torr.
Um diesen Druck (4-5 Zehnerpotenzen höher als bei EI-MS) in der Ionenquelle zu erreichen,
muß die Elektroneneintrittsöffung und die Ionenaustrittsöffnung verkleinert und die
Pumpenleistung des Vakuumsystems erhöht werden.
Die durch den Elektronenbeschuß gebildeten Primärionen des Reaktantgases reagieren durch
eine Serie von Stößen mit weiteren Reaktantgasmolekülen zu den eigentlich ionisierend
wirkenden stabilen Ionen (CI-Plasmaionen). Als Beispiel sei Methan angeführt:
| |||||||||||||||||||||||||||
| Ionisierung durch Protonierung | |||||||||||||||||||||||||||
|
Im CH4-CI-Plasma sind die vorwiegend gebildeten stabilen Reaktantgasionen CH3+
und C2H5+ (protoniertes Ethen). Bei Wasser und Ammoniak dominieren die
protonierten Moleküle [H3O]+ und [NH4]+ sowie deren
Clusterionen mit einem oder zwei weiteren Neutralmolekülen (z.B.
[(NH3)iNH4]+ mit i = 1-2). Bei Isobutan wirkt als protonierndes
Reaktantgasion [C4H9]+, das protoniertem Isobuten entspricht. Diese
Reaktantgasionen sind Brönsted-Säuren. Sie ionisieren Analyt-Moleküle in der Gasphase
durch Protonierung in Ionen-Molekül-Reaktionen.
Die Protonenaffinitäten nehmen in der Reihenfolge [H3]+ > [CH5]+ > [C2H5]+ > [H3O]+ > [C4H9]+ > [NH4]+ ab.
Demnach wird ein gegebenes Analytmolekül durch Protonenübertragung zunehmend schonender ionisiert,
da die Exothermizität der Protonenübertragungsreaktion abnimmt. Auf diese Weise kann durch Wahl des
Reaktantgases das Ausmaß der massenspektrometrischen Fragmentierungen gesteuert werden. | |||||||||||||||||||||||||||
| Ionisierung durch Ladungsübertragung | |||||||||||||||||||||||||||
|
Wird ein Reaktantgas verwendet, das keine protonierenden Spezies bilden kann (z.B. N2, CO2),
so werden Analytmoleküle über Ladungsaustauschreaktionen (charge tranfer reactions) ionisiert.
Dabei entstehen wie bei EI-MS positiv geladene Molekülionen des Typs [M]+•.
Hierbei ist die Differenz der Ionisierungspotentiale (IP) des Analyten und des Reaktantgases entscheidend.
Ist das IP(Reaktantgas)~IP(Analyt), so werden in der Hauptsache Molekülionen
[M]+• gebildet. Ist das IP des Reaktantgases um einige eV größer als
das IP des Analyten (M), so wird das CI-MS-Spektrum einem entsprechendem EI-MS-Spektrum ähnlich,
da in analoger Weise Fragmentierungen durch die auftretende Überschußenergie generiert werden.
Häufig laufen auch mehrere Reaktionen als Konkurrenzprozesse nebeneinander ab. So liefern Alkene mit
Isobutan als Reaktantgas durch Ladungsaustausch mit C4H10+•
[M]+• sowie durch Reaktion mit dem Plasmaion C4H9+,
[M+H]+, [M-H]+, [M+ C4H9]+ und
[M+ C3H3]+. Vorausssetzung für den Ablauf jeder Reaktion ist deren
Exothermizität. Auch hier gilt: Wird bei der betreffenden Reaktion nur wenig Energie frei, so werden
nur Quasimolekülionen oder solche beobachtet, die daraus durch schnelle stark exotherme Prozesse
entstehen können. Beispiel: | |||||||||||||||||||||||||||
| Bedeutung der Chemischen Ionisation | |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| Literatur | |||||||||||||||||||||||||||
| A.G. Harrison, Chemical Ionization Mass Spectrometry, CRS Press Boca Raton, 2. Ed., 1992 | |||||||||||||||||||||||||||