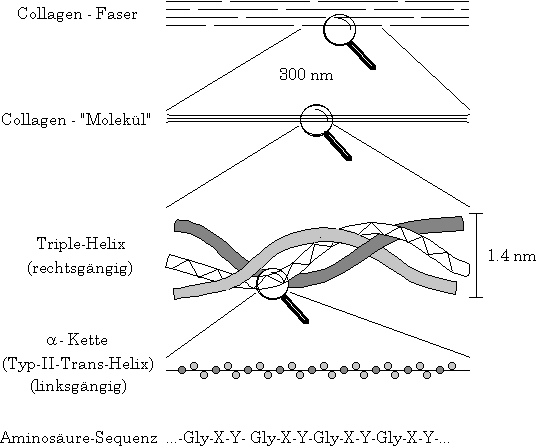
 Gelatine ist ein Abbauprodukt des Kollagens, einer Familie von Faserproteinen.
Die Primärstruktur des Kollagens ist bemerkenswert regelmäßig, praktisch
jede dritte Aminosäure ist ein Glycin. Die
Aminosäuren Prolin und Hydroxyprolin machen zusammen ein weiteres Drittel der
Zusammensetzung aus. Aufgrund des hohen Anteils dieser Iminosäuren, die wegen
ihres großen sterischen Platzbedarfes als "Helix-Brecher" bekannt sind, ist
die Sekundärstruktur des Kollagens nicht die alpha-Helix. Vielmehr bildet
sich eine sehr viel stärker aufgeweitete Helix aus, die der Polyprolinhelix
analog ist. Drei solcher helicaler Stränge falten sich in der Tertiärstruktur
des Kollagens zu einer Triplehelix, die das Tropokollagen aufbaut. Die enge
Windung dieser Superhelix wird durch Wasserstoffbrückenbindungen
stabilisiert und ist erst aufgrund der regelmäßigen Abfolge der kleinen
Glycinreste möglich. Versetzt angeordnet
und an den Enden kovalent quervernetzt bilden die Tropokollagen-"Moleküle"
die Kollagenfaser.
Gelatine ist ein Abbauprodukt des Kollagens, einer Familie von Faserproteinen.
Die Primärstruktur des Kollagens ist bemerkenswert regelmäßig, praktisch
jede dritte Aminosäure ist ein Glycin. Die
Aminosäuren Prolin und Hydroxyprolin machen zusammen ein weiteres Drittel der
Zusammensetzung aus. Aufgrund des hohen Anteils dieser Iminosäuren, die wegen
ihres großen sterischen Platzbedarfes als "Helix-Brecher" bekannt sind, ist
die Sekundärstruktur des Kollagens nicht die alpha-Helix. Vielmehr bildet
sich eine sehr viel stärker aufgeweitete Helix aus, die der Polyprolinhelix
analog ist. Drei solcher helicaler Stränge falten sich in der Tertiärstruktur
des Kollagens zu einer Triplehelix, die das Tropokollagen aufbaut. Die enge
Windung dieser Superhelix wird durch Wasserstoffbrückenbindungen
stabilisiert und ist erst aufgrund der regelmäßigen Abfolge der kleinen
Glycinreste möglich. Versetzt angeordnet
und an den Enden kovalent quervernetzt bilden die Tropokollagen-"Moleküle"
die Kollagenfaser.Gelatine ist das Produkt der Denaturierung von Kollagen. Diese wird durch thermische Behandlung kombiniert mit saurer oder alkalischer Extraktion erzielt. Dabei tritt auch teilweise Hydrolyse auf, so daß die gewonnene Gelatine polydispers ist und etliche ihrer physikalischen Eigenschaften von der Vorbehandlung abhängen. Bei der Denaturierung gehen sämtliche höheren Strukturen des Kollagens verloren, bilden sich in wäßriger Lösung aber teilweise wieder zurück. Dabei treten zwei charakteristische Größen auf: Zum einen ist das die Helix-Coil-Umwandlungstemperatur, oberhalb derer sich keine Helices bilden können und die Gelatine als statistisches Knäuel in Lösung vorliegt. Unterhalb dieser Temperatur kommt es zur Rückbildung der Helices und an einer charakteristischen Gelatinekonzentration, der cgc, findet ein Sol-Gel-Übergang statt. Die Vernetzungspunkte im Gel werden dabei durch die triplehelicalen Bereiche gebildet.